経口抗ウイルス薬モルヌピラビル(ラゲブリオ®カプセル200mg)について

はじめに
新型コロナウイルス感染症に対する初めての経口抗ウイルス薬である「モルヌピラビル(ラゲブリオ®カプセル200mg)」が、2021年12月24日に特例承認されました。MSD製薬が承認申請を出したのが同月の3日ですので、まさにスピード承認です(特例承認前提ではありましたが)。通常、新薬の承認申請後、国による審査期間は約10ヶ月程度ですので(2000~2010年頃は約18ヶ月程度、2011年以降は約10ヶ月と随分短縮された[1])、いかに早い承認であったかが分かります。承認申請のための各種資料作成および承認を見据えての市販後の資材作成に携わった方々、並びに審査する側のPMDA(独立行政法人医薬品医療機器総合機構)の方々の労力は甚大だったろうと想像しますが、国にとっても製薬企業にとっても至上命題であろう「良い薬を必要とする患者さんに届ける」という目標のためには、必要不可欠な尽力だったかと。まずは関係者にお疲れさまでした、と言いたいですね。
さて、このモルヌピラビル(以下、本剤)は、新型コロナ感染症に対する「良い薬」たりうるのでしょうか?日本での承認よりも1日早くFDA(アメリカ食品医薬品局)で承認された本剤ですが[2]、フランスでは有効性が期待ほどではなかったという理由で発注が取り消されるというニュースが流れたりもしました[3]。本稿では、私なりの視点でこの新薬を評価してみたいと思います。
どんな薬なのか?
どんな薬か知りたければ、まずは添付文書に目を通すのが早いでしょう。ですので、添付文書に沿ってみていきますが、適宜、審議結果報告書等も参考にしています。
作用機序は?
本剤はプロドラッグ(生体内で代謝されて初めて活性体に変化して薬効を発揮する薬物のこと)であり、生体内で加水分解されて生じた活性代謝物が、新型コロナウイルス複製過程でウイルスゲノムに取り込まれることで、ウイルスゲノムの複製エラー頻度が増加、結果的に新型コロナウイルスの増殖抑制に働くようです[4]。
どんな患者さんに投与されるのか?
ざっくりと言えば、「新型コロナ感染症の重症化リスク因子を有する軽症から中等症の患者さん」です。つまり自宅療養できそうな患者さんが対象ですが、投与の対象となる患者さんについては後ほど補足します。
添付文書には「SARS-CoV-2による感染症の重症化リスク因子を有する等、本剤の投与が必要と考えられる患者に投与すること。」との記載があり、また、投与対象年齢は、18歳以上となってます。リアルワールドでは、17歳以下のお子さんもコロナにかかるので、投与したい場面が出てくるかもしれませんが、承認される際の評価資料だった国際共同第Ⅱ/Ⅲ相試験[MOVe-OUT(002)試験](以下、MK-4482-002試験)での組入れ年齢は18歳以上でしたので、17歳以下には投与経験がなく臨床データはありません。もっとも、若い年齢というのは、新型コロナの重症化リスクではなく、その観点からは18歳未満の患者さんに投与出来ないことで焦燥に駆られる場面はほぼないだろうとも思います。
なお、「重症度の高いSARS-CoV-2による感染症患者に対する有効性は確立していない」ですので、診断時点で呼吸不全を呈しており(SpO2が≦93%)、入院下での酸素投与が必要な患者さんは(中等症IIレベル相当)、本剤の投与対象外であり、速やかな入院措置が必要です。
用法・用量は?
「通常、18歳以上の患者には、モルヌピラビルとして1回800mgを1日2回、5日間経口投与する。」とあります。ラゲブリオ®のカプセルが200mgですので、1回で4カプセル(!)を朝夕に内服するイメージです。1日8カプセルも!と思いますが、まぁこれで重症化予防が期待出来るのであれば、私なら迷わず内服しますね(仮にコロナにかかったとして)。
新型コロナ感染症の重症化リスク因子とは?
厚労省が本剤承認日の令和3年12月24日に発出した事務連絡にまとめてありますが、そこで引用されている日本感染症学会の「COVID-19 に対する薬物治療の考え方 第 11 版 」の基準を引用します。
- 61 歳以上
- 活動性の癌(免疫抑制又は高い死亡率を伴わない癌は除く)
- 慢性腎臓病
- 慢性閉塞性肺疾患
- 肥満(BMI 30kg/m2 以上)
- 重篤な心疾患(心不全、冠動脈疾患又は心筋症)
- 糖尿病
- ダウン症
- 脳神経疾患(多発性硬化症、ハンチントン病、重症筋無力症等)
- コントロール不良の HIV感染症及びAIDS
- 肝硬変等の重度の肝臓疾患
- 臓器移植、骨髄移植、幹細胞移植後
ここで注意しておきたいのは、上記などに該当する重症化リスクを有していないと投与できないのか?という疑問についてですが、そんなことはありません。審査報告書の「臨床的位置づけ」の項には、以下の記載があり非常に重要な文言です。
また、国際共同第Ⅱ/Ⅲ相試験(MK-4482-002試験)の第Ⅲ相パートは SARS-CoV-2 による感染症の重症化リスク因子を有する患者が対象とされたが、本邦において、重症化リスク因子を有しない軽症~中等症の患者における治療選択肢はないこと、当該試験において本剤の抗ウイルス薬としての有効性は示されており、重症化リスク因子を有しない患者に対する有効性も類推可能と考えること、本剤は経口剤であり軽症~中等症の患者への投与に適した剤形であること等を踏まえると、本剤の投与対象は重症化リスク因子を有する患者が中心ではあるものの、高熱や呼吸器症状等の相当の症状を呈し重症化のおそれがある場合等、本剤の投与が必要と考えられる患者に対して投与可能としておくことは有用と考える。
これを受けてでしょう、添付文書の注意書きとして「…SARS-CoV-2による感染症の重症化リスク因子を有する等、本剤の投与が必要と考えられる患者に投与すること。」となっており、この「等」の1文字が肝要です。ここに「医師の裁量」が入る余地があるわけです。ただ、伝家の宝刀とも言える医師の裁量権ですが、本剤に関しては、安定的な供給が難しく、国が所有して配分するという現状を踏まえ、臨床医には、適切に必要な患者さんに処方するという心構えが求められます。
妊婦や妊娠している可能性のある女性には?
妊娠している女性又は妊娠している可能性のある女性には投与不可となっています(禁忌)。理由は、動物実験で胎児の体重減少、流産、奇形などの胎児毒性が認められているからです。MK-4482-002試験では妊婦は除外されていため、妊娠している女性への投与に関する安全性情報は得られていませんが、非臨床試験成績(動物実験)を踏まえて、本剤が潜在的な催奇形性リスクを有する可能性があると判断されました。「禁忌」とは、やや保守的な判断かと思いますが、妊婦に対して投与可能なレムデシビルやモノクローナル抗体があることを踏まえて、という側面もあります。
なお、妊娠する可能性のある女性に対しては、本剤投与中および最終投与後一定期間(少なくとも最終投与後4日間)に性交渉を行う場合は、パートナーと共に適切な避妊を行うよう指導してくださいね、とRMP(医薬品リスク管理計画)関連資材に記載があります[5]。
授乳中にラゲブリオは内服可能か?
添付文書では、「治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。」との記載で、なんとも玉虫色の文言ですが、少なくとも禁忌ではありませんので、ベネフィットとリスクを勘案して、医師の判断によっては投与可能ということです(医師の裁量権)。
ちなみに、審査報告書では、
授乳婦への投与については、本薬を授乳婦へ投与した場合の乳汁移行性は不明であるものの、ラットを用いた出生前及び出生後の発生並びに母体の機能試験において、新生児発育に対して、本薬曝露の影響が認められないことから、授乳に対する安全性上の懸念は低いと考える。
という記載があるので、投与禁忌である妊婦さんに比べると投与のハードルはかなり低いと判断しますし、RMPにおいて「重要な潜在的リスク」として挙げられているのは、「骨髄抑制」と「催奇形性」のみです[6]。
「良い薬」なのか?
さてようやく本題です。良い薬なのかどうかは、治療によるベネフィットが副作用等のリスクを上回るというのが最低ラインで、国が特例承認をしたということは、有効性と安全性とが一定の基準を満たしたからになります。薬の有効性と安全性は、承認を得るための臨床試験(治験)で評価され、その結果は、添付文書の「臨床成績」の項をみると書いてあります。ここでは、主要試験であるMK-4482-002試験のデータを中心に見ていきましょう。
有効性について
さて、ラゲブリオ®の有効性はどんな感じでしょうか、添付文書から抜き出してみます。
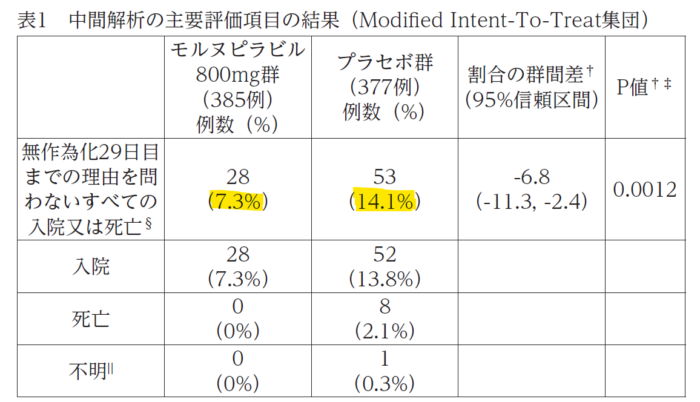
ちょっと意外でしたが、添付文書には、(目に付きやすい表としては)無作為化されたすべての被験者(1,433 例)の無作為化 29 日目までの有効性及び安全性の解析データ[12月16日にNew England Journal of Medicine (NEJM)誌上で発表されたデータ;この解析データをみて、フランス当局は本剤の購入を取り消したと思われます ]ではなくて、中間解析の結果が載せてあります(775例)。が、考えてみれば、予め規定された中間解析の結果、有効中止(治験を続けることでのプラセボ群の不利益等を考慮してでしょう、有効性はあるよね、ということで外部データモニタリング委員会からの中止勧告でした)となったことから、中間解析で得られた主要評価項目の結果が主たる結果ということになり、このデータをもって当該治験の成果を評価するというのは間違ってはいないとは思います。
この中間解析だけみれば、本剤は入院または死亡のリスクを約50%下げていることになり(7.3% vs. 14.1%)、その内訳でも、本剤群では死亡例はなく、プラセボ群では死亡8例と、もっとも避けたい事態で差がみられてますし、各群で400例弱というサンプルサイズとしては「まぁ、悪くない」結果です。
では、当局(PMDA)は、このデータだけで承認をしたのかというとそんなことはなく、きちんと追加で得られたデータもみて判断していますし、「なおがき」として添付文書にも記載があり以下の通りです。
なお、無作為割り付けされた1433例(日本人被験者8例を含む)全例における補足的な解析での主要評価項目の結果は、モルヌピラビル800mg 群6.8%(48/709例)及びプラセボ群9.7%(68/699例)であり、割合の群間差は-3.0%(95%信頼区間:-5.9, -0.1)であった。内訳は、モルヌピラビル800mg群で入院 48/709例(6.8%)、死亡 1/709例(0.1%)であり、プラセボ群で入院 67/699例(9.6%)、死亡 9/699例(1.3%)、不明 1/699例(0.1%)であった。
表としては、審査報告書に載っていて、以下のようです。
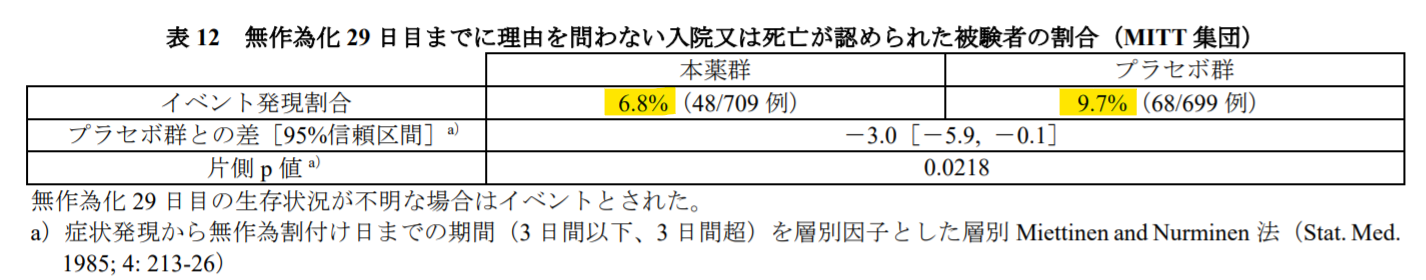
中間解析時点よりも、サンプルサイズが倍近くになっていて、本剤は入院または死亡のリスクを約30%下げていることになります(6.8% vs. 9.7%)。ここの数字だけみれば、群間差はたった3%で、フランス当局ががっかりしたのも首肯できます。じゃ、有効性は否定されるのかというと、そんなことはなく、着目すべきは、中間解析との数字の比較です。本剤群では、入院又は死亡にいたるリスクは7.3%から6.8%とそんなに変わりません(むしろ若干良くなっている)。一方で、プラセボ群では当該リスクが14.1%が9.7%と大幅に良くなっているのです。換言すれば、プラセボ群が頑張った、健闘した、ということになります。
どうしてプラセボ群のリスクが低減したのかは、NEJMの論文でも議論されていますが、「よく分からない(unknown)」と言ってます。可能性として、ランダム化した群間サンプルの微妙な偏りが集積した結果だとか、新型コロナウイルスの変異株がシフトした影響(アルファ株からデルタ株など)、各国で組入れる患者さんの地域差だとか挙げられていますが、どれも決定打に欠けるようです。
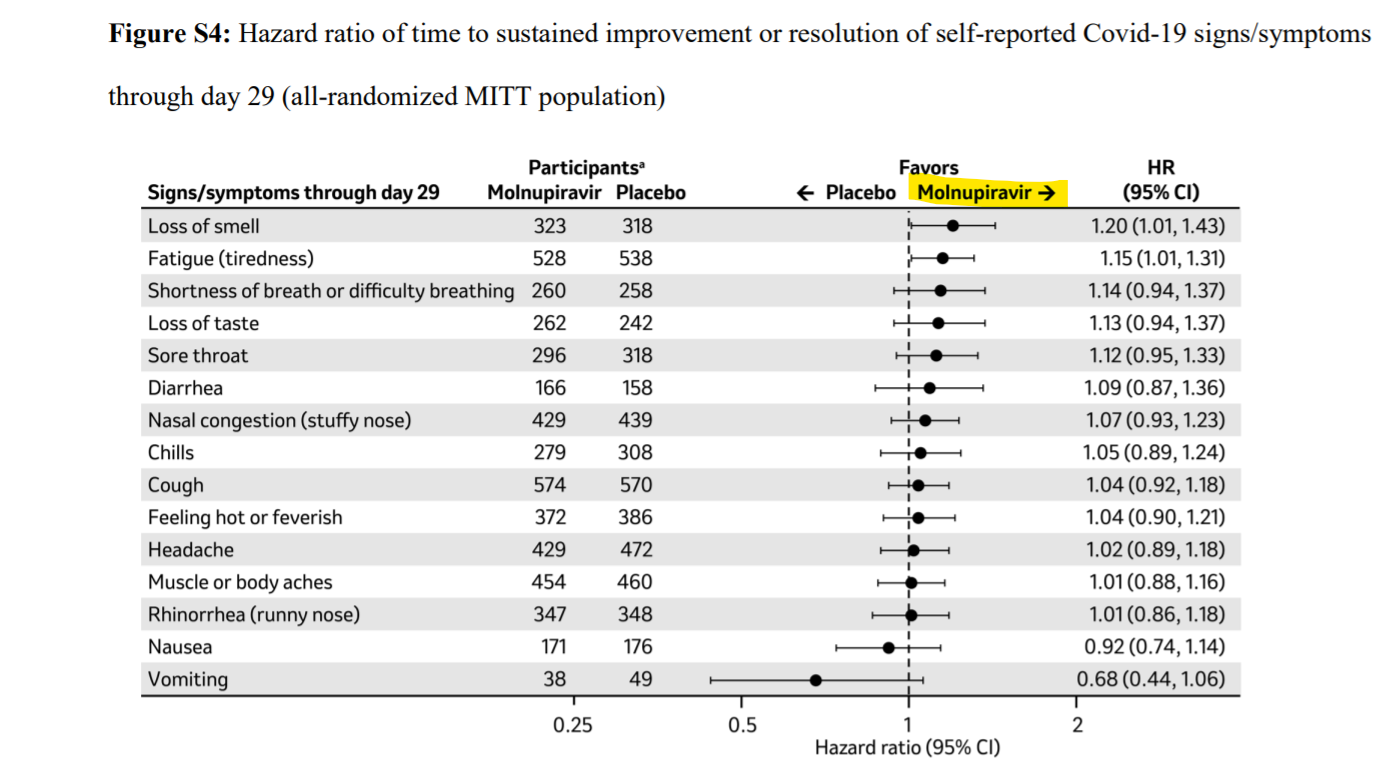
主要評価項目は、上記のように、無作為化29日目までに理由を問わない入院又は死亡が認められた被験者の割合でしたが、副次評価項目として、患者さんの報告による自覚症状の改善度合いがあり、そちらも以下のように本剤群で良い傾向にあります。特に、コロナ後遺症(Long COVID)としてもみられる味覚障害や倦怠感がプラセボ群より改善しているのは注目すべき点かと思います(NEJMの論文のFigure S4)。MK-4482-002試験は、2重盲検試験、つまり患者さん側も医療側も、モルヌピラビルが投与されているのか、それとも偽薬(プラセボ)が投与されているのか分からないようにデザインされ、実施されています。そういう観点からも、バイアスのない自覚症状の改善ですので良い結果であろうと思います。
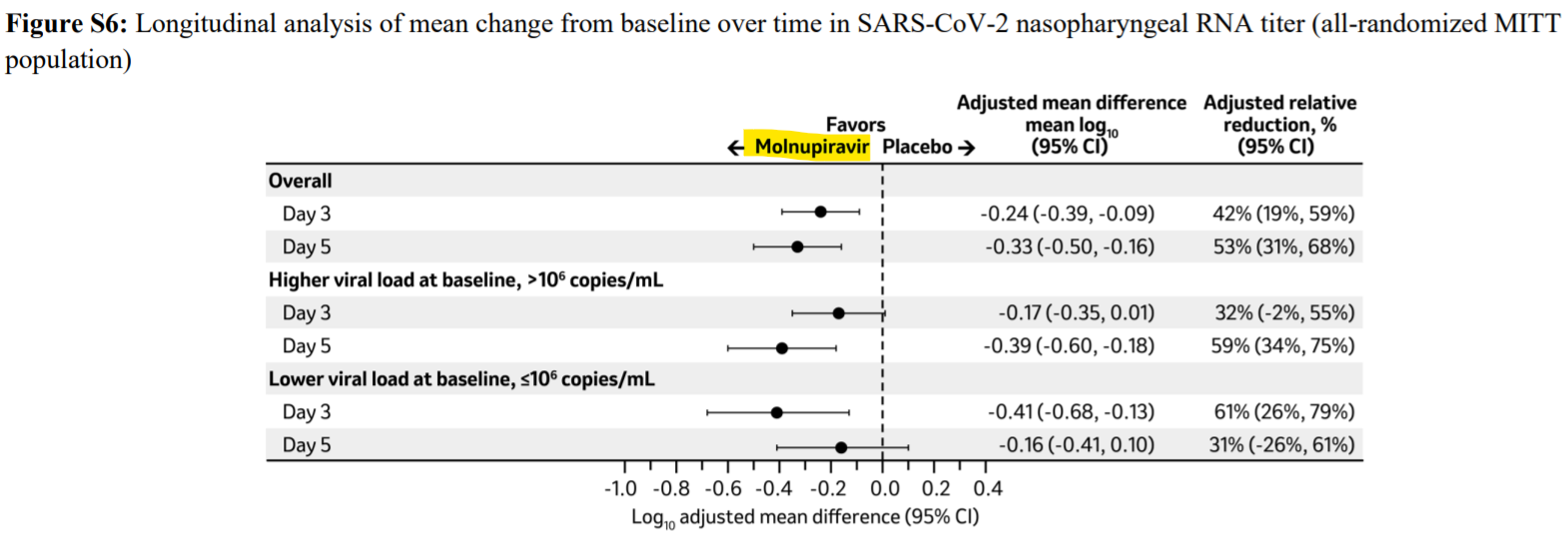
なお、MK-4482-002試験において、探索的な評価にはなりますが、個人的に良いなと思うのは、鼻咽頭ぬぐい検体でのウイルス量が、3日目、5日目といずれもプラセボ群と比して低下していることです。以下、NEJMの論文のFigure S6の図を載せておきます。きちんと、作用機序通りの薬効を示してます。
最後に、変異株に対する有効性が気になるところですが(例えば、抗体薬のロナプリーブは、オミクロン株に対する中和活性の低下が報告されており、当該患者に対する投与は非推奨です[7])、「製造販売業者によると、in vitroでの検討において、アルファ株、ベータ株、ガンマ株、デルタ株、ラムダ株、ミュー株、オミクロン株に対して、野生株と同程度の抗ウイルス活性が認められていることが確認されている」(令和3年12月24日の事務連絡 p.11)とのことなので、オミクロン株に対しても問題なさそうですし、何より、変異を生じやすいウイルスの特定のゲノム領域をターゲットにした薬ではないので、作用機序的にも耐性株は生じにくいのではないかと予想されます。
安全性について
さて、安全性です。どんなに有効性が高くても、安全性の懸念があれば良い薬たりえませんし、程度によっては承認すらされません。まずは、添付文書の当該項を抜き出してみます。

たった、これだけです。普通、添付文書には、「重要な基本的注意」の項があり、そこに、懸念すべき副作用が記載されるのですが、まずその項がありません。また、上記と同じ「副作用」の項にも、「重大な副作用」含め、ずらずらっと臨床試験等で明らかになった副作用が列挙されるものですが、それすらなく、たったこれだけです。こんな感じですので、RMPでも「重要な特定されたリスク」は「該当なし」となっています。もちろん、リアルワールドで投与例数が増えるにつれて、臨床試験では同定されなかった副作用が見いだされるかもしれませんが(同定された副作用は添付文書に追記されます)、それにしても特筆すべき副作用の少なさです。参考までに、興味がある方は、同じ抗ウイルス薬であり(1日2回、5日間の経口投与という用法もたまたま同じ)、多くの先生方に処方経験があるであろうタミフルの添付文書と見比べて下さい。
では、MK-4482-002試験での安全プロファイルはどんな感じだったのでしょうか。審査報告書にまとめられているものが以下になります(上位のもの)。「有害事象」でみてみると、本剤とプラセボ群とでは似たような感じかややプラセボ群で多いかなという印象です(35.0% vs. 39.6%)。「副作用」でみてみると、こちらも両群で同様な安全性プロファイルとなっており(12.4% vs. 11.1%)、偽薬と差がないということは、本剤の副作用の少なさの裏返しでもあります。
ちなみに、表中で有害事象の最頻度が「COVID-19」となってます。COVID-19と診断された患者さんが対象なのに、これいかに?と思いますが、NEJMの論文を見ると、どうやら「COVID-19の増悪(worsening of Covid-19)」ですね(安全性データベースに登録する際のMedDRA絡みのcoding上、こういう表記になってしまうのかもしれません)。ここで差がありそうですが(8.0% vs. 14.8%)、それだけ本剤群で効いているのかなという印象を持ちます。
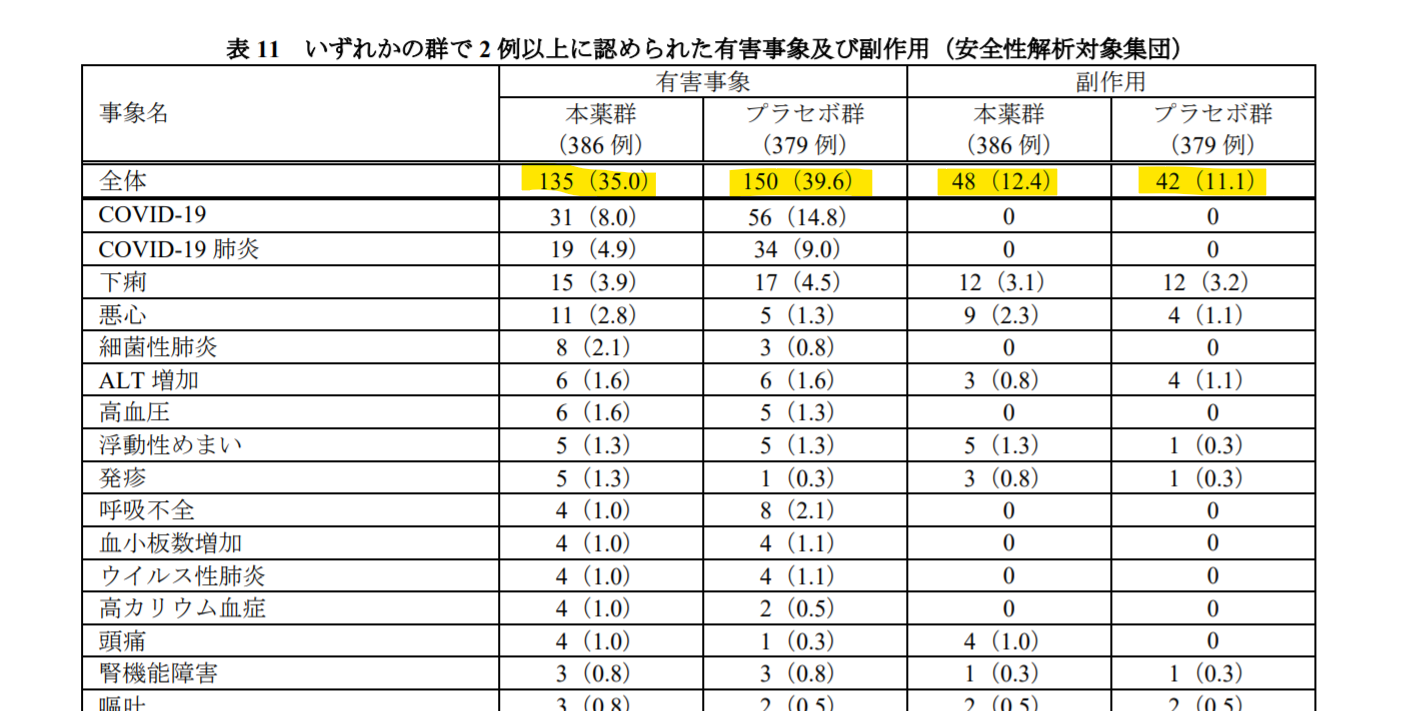
蛇足ながら、上表には「有害事象」と「副作用」とありますが、この2つは明確な違いがあります。「有害事象」とは、因果関係の有無を問わず、単に医薬品の使用によって生じたあらゆる好ましくない有害な反応のことです(英語ではAdverse Event)。極端な話、不幸にも治験中に落雷に遭ったとします。すると、この好ましくない事象は有害事象として報告されます。あくまで因果関係は不問です。一方で、「副反応」とは、医薬品の使用によって生じ、医薬品との合理的な可能性がある(~因果関係を否定できない)有害な反応のことを指します(英語ではAdverse Drug Reaction)。なので、副作用は有害事象の中に含まれますし、添付文書に記載されるのは、因果関係ありと判定された副作用になります。
安全性に関して、更に良いなと思うポイントは、本剤は、腎機能障害者や肝機能障害者に対しての用量調整が不要ですし、高齢者と若年者で薬物動態は同様ですし、また薬物相互作用も気にしなくて良いということです。新型コロナ感染症の重症化リスクを有している患者さんは、ほぼほぼ該当するリスクに対する内服薬を(数種類)服用しているでしょう。そういう患者さんに対して、薬物相互作用を気にせずに投与出来るというのは、臨床の現場では助かります。
個人的に気になる点
さて、これまで見てきて、有効性はまぁそこそこ期待できるかなぁ、という印象です。安全性は、妊娠している女性または妊娠している可能性のある女性に対しては禁忌である点を除けば、今のところ、これといった懸念はないので、投与対象の患者さんがいれば、処方するのにほぼ迷いはないですね。「ほぼ」と言ったのは、個人的に気になる点があるからです。それは、MK-4482-002試験において(その他の関連する臨床試験でも)、
新型コロナワクチンの接種歴のある患者さんは除外されていた
ことです(添付文書でもきちんと言及されています)。つまり、新型コロナに対するワクチン接種歴のある患者さんは、除外基準により参加できなかったのです。ワクチンを2回接種したにもかかわらずCOVID-19になってしまう、いわゆるブレークスルー感染は、コロナ関連ニュースでも度々取り上げられますし、日本の総人口の78%がワクチンを2回接種済という状況下(令和3年12月26日時点)[8]、今後、ブレークスルー感染は当たり前のように目にするでしょう。なのに、ワクチン接種歴のある患者さんでの臨床データがないのは残念ですねぇ。勿論、ワクチン接種歴の有無は、ラゲブリオ®投与可否の判断には何ら影響しないのですが、ワクチン接種歴ありの方のデータを予め見たかったなぁと思います。まぁ今後、リアルワールドでのデータ集積に伴い、そこに着目した論文も出てくるでしょうから、今後も注視していこうと思います。
果たして良い薬なのか?
これまでの考察を踏まえて、私の個人的な判断になりますが「良い薬」ですね。何より、懸念すべき副作用がほとんどないというのが大きいです。飲み合わせも考慮しなくてよいし、用量調整も不要。これで有効性がピカイチだったら言うことないんですけどね。ともあれ、現状において入手できる唯一の経口薬として良い薬だと思いますので、当院では処方すべきタイミングで処方出来るように、最低限の数を確保しています(院内処方です)。
なお、米国では、ラゲブリオ®に1日先行して、FDAがファイザーの新型コロナ治療薬であるPaxlovidに緊急使用許可を与えています(なので日本での新型コロナ経口薬はラゲブリオ®が最初ですが、米国ではファイザーのPaxlovidになります)[9]。こちら、ラゲブリオ®と同様1日2回の5日間の内服で、かつ、投与対象の患者さんはCOVID-19の診断がついた軽症から中等症の成人および12歳以上の小児、ならびに重症化リスクのある患者となっていますし、何より有効性がすこぶる良いです。プラセボ群と比して、入院または死亡のリスクを88%も低減させてます(0.8% vs. 6%)。有効性がすこぶる良いので、もし日本でPaxlovidが承認されたら、実地ではこちらが選択される可能性が大きそうですが、Paxlovidは、腎機能や肝機能障害の患者さんには用量調整が必要そうですし、そのうち2剤の間での使い分けも出てくるでしょうね[10]。
新型コロナとの戦いは、まだまだ続きそうですが、変異箇所がやたらと多いオミクロン株は、その強い感染力の割には、重症化リスクはそれほどでもないようですし、複数の抗体薬に加え、経口の抗ウイルス薬も出てきて、新型コロナ感染症との戦いは新たなフェーズに入りつつあるのかなと思います。
■ 了





近隣に在住の者です。いつもお世話になっております。興味深い記事の掲載有難うございます。
本記事によりますと、このモルヌピラビルのメリットとして副作用が少ない(安全性が高い)ことを挙げられていますが、
本日ネットの記事を見ていたところ、逆に副作用が懸念される、というような記載がありました。
https://news.yahoo.co.jp/articles/e02d852e0ae46c043a39d93213e357b0525f10f4
たった数行で、信ぴょう性も?かと思いますが、「ガンのリスク」などと書かれるとちょっと気になってしまいます。これについてはいかがでしょうか。